ATC2022深度解读(一):ddcfDNA临床使用场景及使用经验总结篇
——
随着ddcfDNA在肾移植临床应用规模不断扩大,全球各移植中心不断深化对ddcfDNA与传统金标准肾穿刺活检之间协同价值的认知,并不断总结ddcfDNA在临床的使用场景及临床获益方面的经验,过去一年来涌现出了丰硕的研究成果。本次ATC有四篇代表性研究,接下来我们进行解读。
来自美国克利夫兰大学医院克利夫兰医疗中心(University Hospitals Cleveland Medical Center,
Cleveland, OH)的研究肯定性地回答了这个问题。
该中心一直开展程序性活检,在肾移植的“零点/灌注前”,“术后10-14天”,“术后3个月”和“术后12个月”这四个时间分别进行穿刺活检。通过回顾性研究发现,ddcfDNA可能有助于对移植后DGF/SGF患者的临床决策,消除近60%的不必要活检。
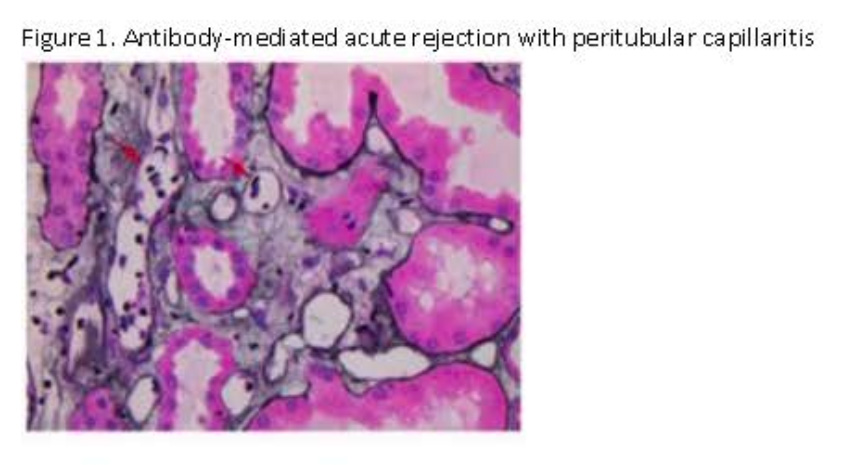
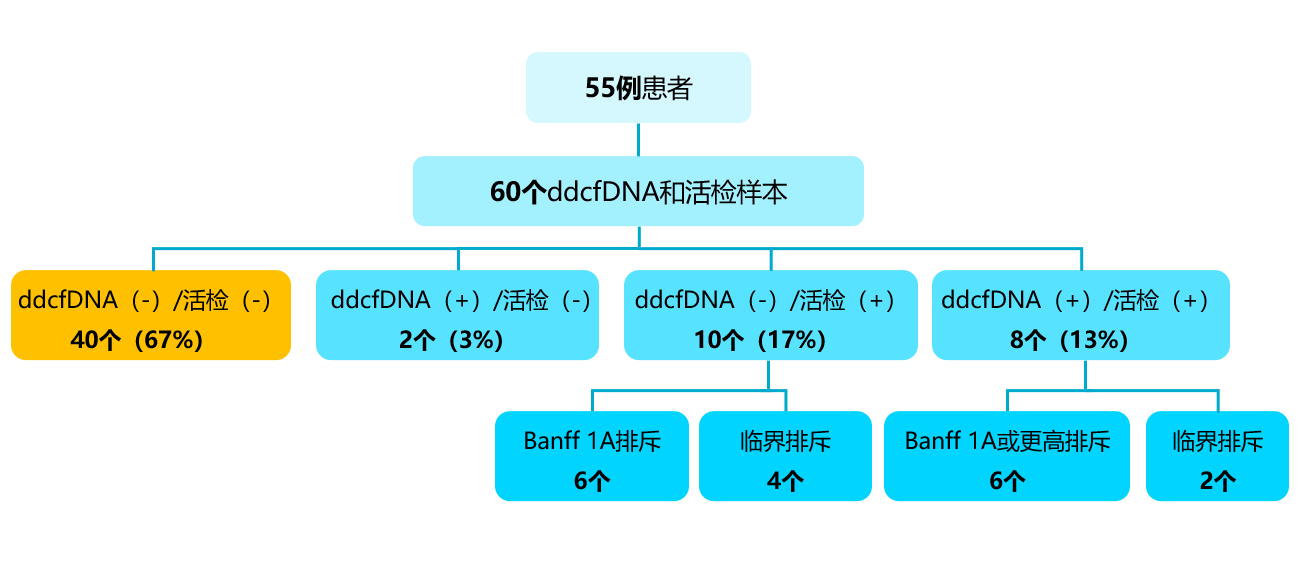
通过对55例患者共67个ddcfDNA和病理配对样本(7个可能为ABMR)分析显示:其中40个ddcfDNA和病理活检结果均为阴性,2个ddcfDNA阳性、活检阴性,4个病理显示Banff 1A排斥反应而ddcfDNA结果阴性,6个病理显示临界排斥反应患者的ddcfDNA结果也为阴性;6个Banff 1A或更高级别的排斥反应和2个临界排斥反应中ddcfDNA和活检结果均阳性[图1]。如果仅考虑Banff 1A或更高级别的排斥反应,ddcfDNA的阴性预测值(NPV)为91.3%,特异性为95.5%。如果包括临界性排斥,ddcfDNA的NPV下降至82.3%。
[图1]
Second Research: 既然通过ddcfDNA检测可以减少不必要的穿刺活检,那么临床能否进行ddcfDNA的早期筛查,通过参考ddcfDNA结果的指征变化来针对性地进行穿刺活检,提高病理活检的效率和收益率?
来自美国马里兰大学医学院(University of Maryland School of Medicine, Baltimore,
MD)等中心的研究表明ddcfDNA监测下的临床活检指导,可以提高组织病理活检结果的“Histological Yield and
Actionable Findings”。
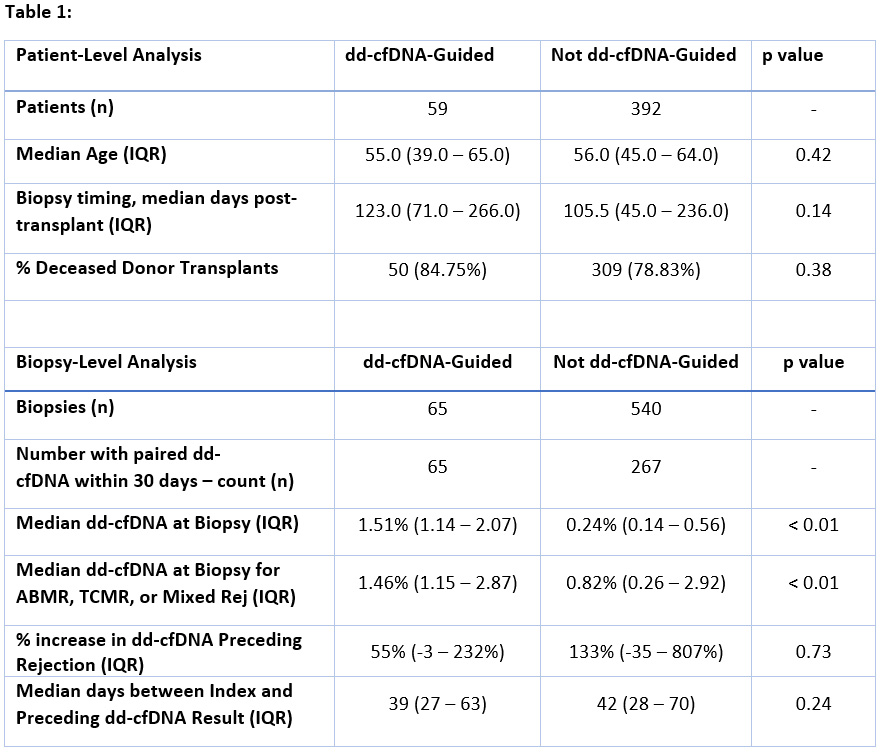
这项多中心研究,通过对1663名肾移植受者进行ddcfDNA检测随访,共收集了540份传统临床指征性活检的病理结果,和65份因ddcfDNA升高指导的病理活检结果。各组病例年龄、死亡供体百分比和移植后活检时间无显著差异[表1]。
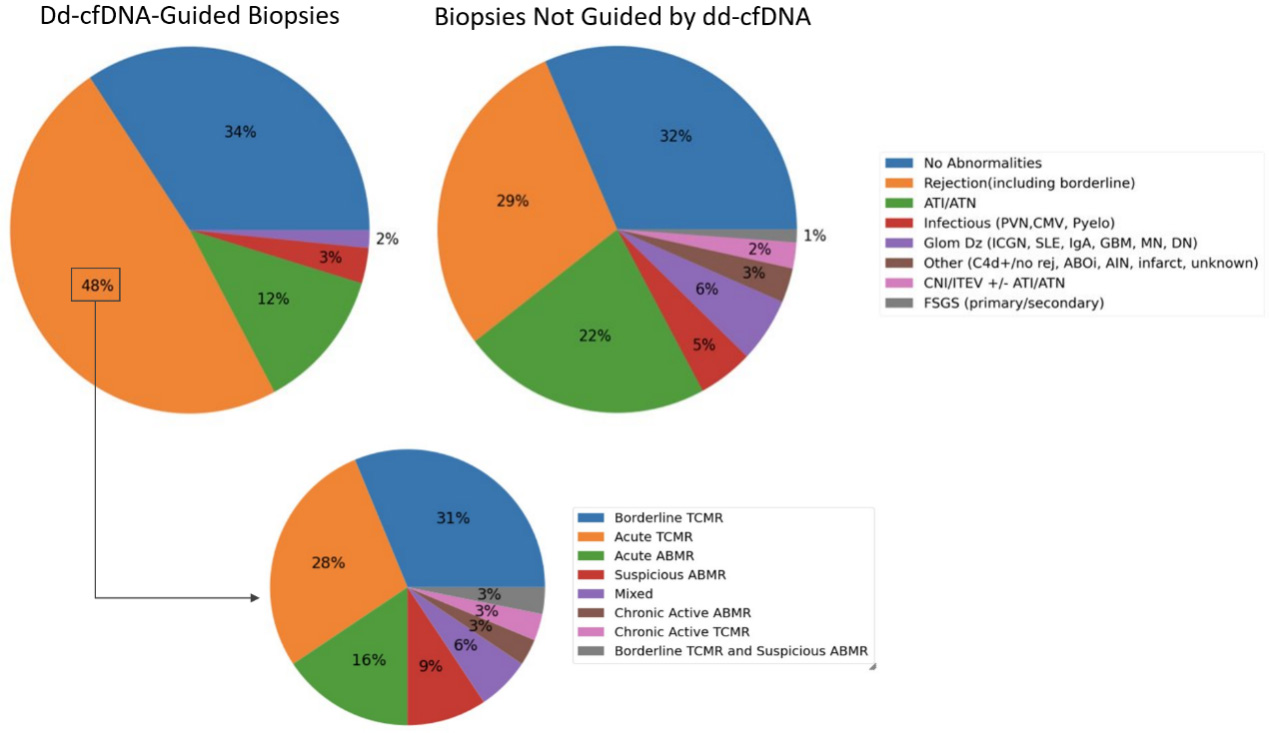
ddcfDNA引导的活检与传统指征性活检(传统指标)相比,显著增加了对排斥反应的检出率(48% VS 29%),且ATI/ATN病例更少(12% VS 22%)(p < 0.05)[图2]。在ddcfDNA引导的排斥反应活检(ABMR、TCMR或混合排)中,ddcfDNA中位值为1.46%(IQR:1.15–2.87)。在传统指标引导进行活检但ddcfDNA未升高的267个病理结果中,ddcfDNA中位值为0.24%, 其中有排斥反应的样本中ddcfDNA中位值为0.82%,其检测值比排斥发生之前增加了133%。
因此,ddcfDNA检测能够为活检增加决策依据。即使存在用于指导活检决策的其它临床因素,较低的ddcfDNA值也可以帮助避免活检。
Third Research: ddcfDNA检测能否发现其它临床指标未能提示的排斥反应?
来自奥克斯纳基金会医院(Ochsner Foundation Hospital, New Orleans, LA)以“Modern
Medicine Needs Modern Technology Tools”为标题,报道了三例肌酐稳定的肾移植受者的动态ddcfDNA监测结果,印证了ddcfDNA检测在早期筛查亚临床排斥反应方面的价值。
病例一:因继发于HIV感染的ESRD而进行了DCD肾移植。术后肌酐稳定在1.1mg/dL至1.2mg/dL。该病例在移植后第1、2、3、4、6和9个月时分别接受ddcfDNA检测。结果显示第1-6个月的ddcfDNA检测值< 0.21%,表明肾功能稳定。然而,在第9个月检测时,ddcfDNA值上升至4.5%,表明供肾可能存在损伤,此时病例肌酐依旧稳定在1.2 mg / dL, DSA II类弱阳性。 虽然此时肌酐稳定且DSA水平较低,但由于ddcfDNA值急剧升高,临床进行了活检,结果提示急性TCMR和急性ABMR。
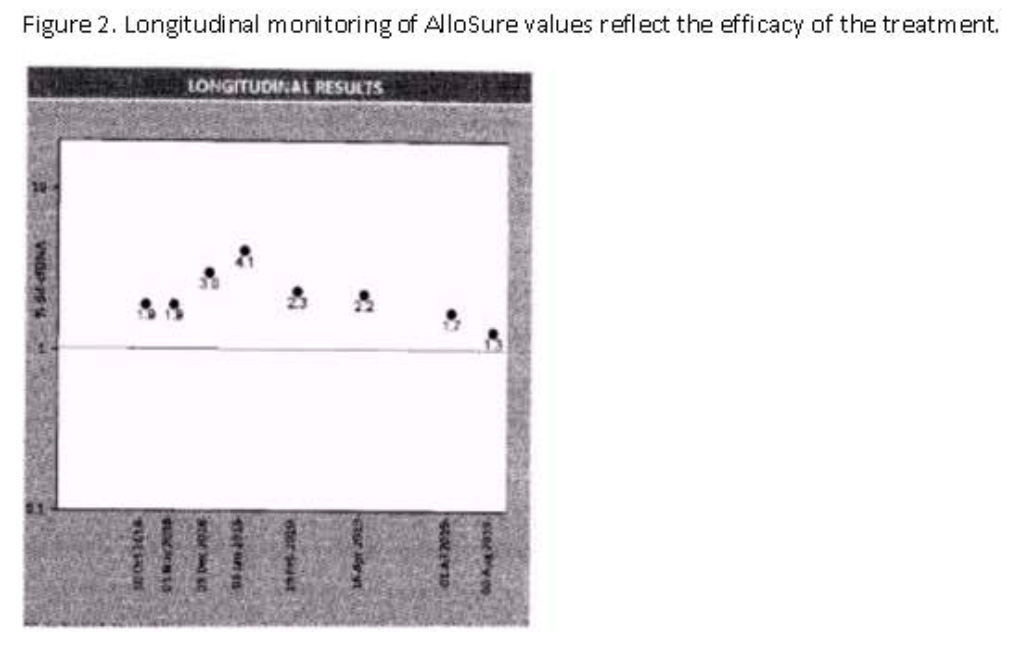
病例二:为重复肾移植患者,术后肌酐稳定在1.0~11.3 mg/dL,第1和第2个月的ddcfDNA值分别为< 0.21%和0.32%。第3个月时,ddcfDNA值升至0.78%,DSA为阴性。该病例因ddcfDNA值升高进行活检,提示为急性ABMR[图3]。
[图3]
病例三:有继发于高血压的ESRD病史。肾移植术后数月,病例出现急性肾衰竭(肌酐从1.2 mg/dl升至1.7 mg/dL),活检提示急性ABMR和TCMR,已接受治疗。他在移植后1年内接受每月ddcfDNA监测。首次ddcfDNA值为1.9%,表明可能存在移植肾损伤。且ddcfDNA监测结果显示,ddcfDNA值呈上升趋势,高达4.1%,而肌酐稳定在1.2 mg/dL-1.3 mg/dL。此时活检提示为acute ABMR和chronic active antibody rejection。该病例接受了ABMR治疗,并进行了为期6个月的每月一次利妥昔单抗治疗。治疗期内,ddcfDNA呈现下降趋势[图4]。
[图4]
Fourth Research: 单一的ddcfDNA检测就能够发现早期亚临床排斥反应,那么使用ddcfDNA与基因表达组合检测能否提高亚临床排斥的检出率?
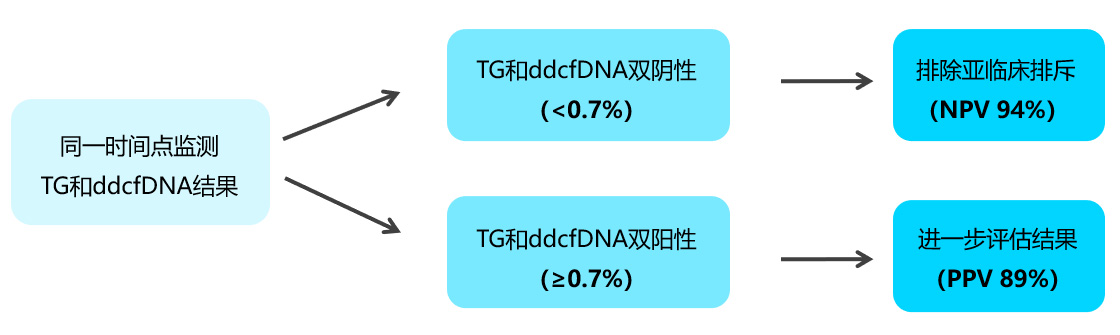
来自美国马萨诸塞州贝斯泰特医疗中心(Baystate Medical Center, Springfield, MA)等分享了在肾功能稳定的患者中同时使用基因表达(TG)和ddcfDNA(TRAC)组合监测(OmniGrafs)排斥反应的早期经验。TG和ddcfDNA双阴性(<0.7%)排除了亚临床排斥(NPV 94%),而TG和ddcfDNA双阳性(≥0.7%)则提示需进一步临床评估(PPV 89%)[图5],如穿刺活检、检测DSA等。
[图5]
在使用OmniGraf监测之前,用TG和ddcfDNA同时或分别对13例肾移植受者进行了连续监测。对不一致结果进一步评估发现:4个阴性TG/阳性ddcfDNA中,有3个DSA呈阳性,其中只有50%的患者蛋白尿阳性。基于OmniGraf监测,8个肾移植受者中有6个避免了移植3个月时的程序性活检。
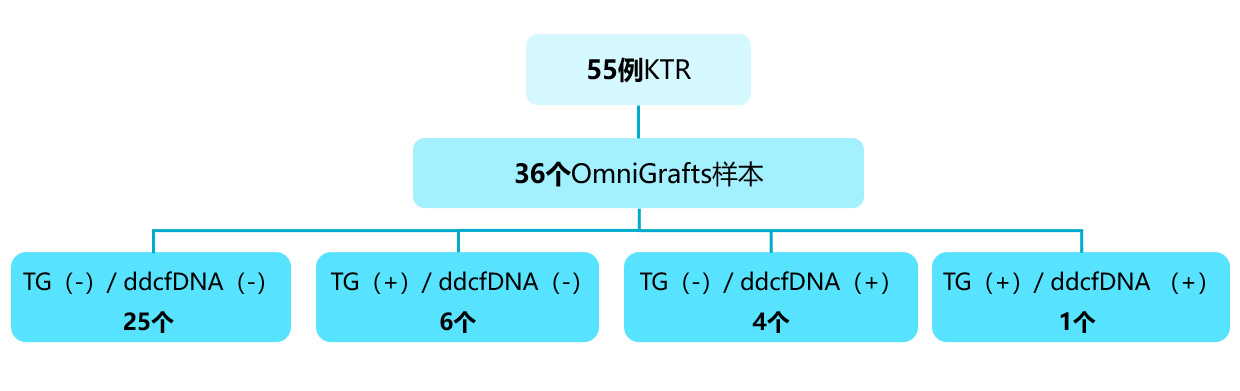
本次研究中,有35名肾移植受者接受了36次OmniGrafs检测。其中25例为双阴性(TG阴性/ddcfDNA阴性),证实了免疫抑制的充分性。10例不一致(6例TG阳性/ddcfDNA阴性;4例TG阴性/ddcfDNA阳性),1例双阳性 (TG阳性/ ddcfDNA阳性 ),需要进一步检查[图6]。
[图6]
使用基因表达和ddcfDNA组合监测,实现了移植术后3个月和12个月时,不使用穿刺活检就能排除亚临床急性排斥反应,确认了免疫抑制的充分性,并提供协同信息以与其他临床数据(如DSA)一起考虑。该中心认为有必要进行更大规模的研究,以确定OmniGraf最佳检测频率和方法。
综上四篇研究结果,ddcfDNA检测在临床使用场景及经验的总结为:
一、 通过ddcfDNA检测可以减少不必要的穿刺活检;
二、在ddcfDNA检测指导下的活检可以提高病理结果的收益及效率;
三、使用ddcfDNA或ddcfDNA相关组合检测,能够早期发现亚临床排斥反应。
First Research: 通过ddcfDNA研究到底能否减少临床不必要的穿刺活检?

 [图2]
[图2]